Руководствуясь электронной теорией окислительно-восстановительных процессов, рассмотрим, чем отличаются реакции замещения от реакций обмена.
Составим уравнения реакций сульфата меди (II) с гидроксидом натрия и железом, а алюминия — с соляной кислотой в молекулярном, ионном и сокращенном ионном виде.
Над химическими знаками проставим их степени окисления и стрелками покажем переход электронов:
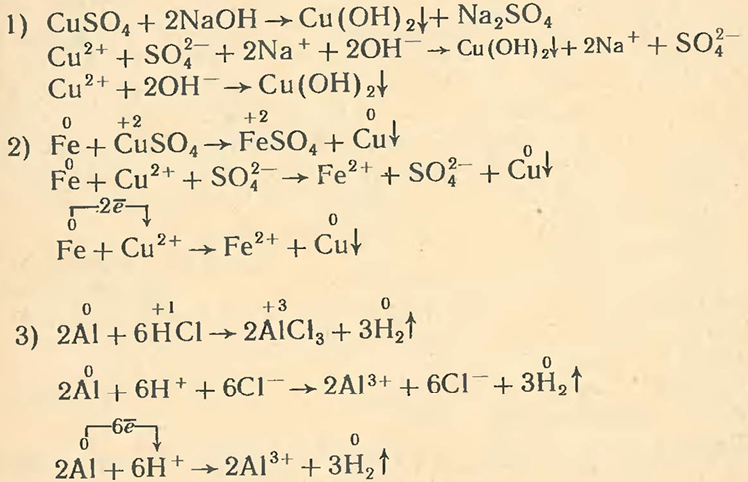
По уравнению видно, что степень окисления изменяется во второй и третьей реакциях.
а) атомы железа окисляются в ионы железа;
б) ионы меди восстанавливаются в атомы меди;
в) окислителями являются ионы меди, которые окисляют атомы железа и сами восстанавливаются;
г) восстановителями являются атомы железа, которые восстанавливают ионы меди и сами окисляются.
а) атомы алюминия окисляются в ионы алюминия;
б) ионы водорода восстанавливаются в атомы водорода, из которых образуются молекулы водорода;
в) окислителями являются ионы водорода, которые окисляют атомы алюминия и сами восстанавливаются;
г) восстановителями являются атомы алюминия, которые восстанавливают ионы водорода и сами окисляются.
Следовательно, реакции замещения, в отличие от реакций обмена, являются окислительно-восстановительными.