Уравнения реакций обмена мы до сих пор изображали только в молекулярном виде. Однако в водных растворах все электролиты в той или иной степени ионизированы, и поэтому реакции происходят между ионами.
С условиями протекания таких реакций можно ознакомиться опытным путем
1. К раствору хлорида натрия приливают раствор нитрата серебра (I) или нитрата свинца (II); в результате реакции выпадает осадок.
2. Раствор соляной кислоты приливают к раствору карбоната натрия: выделяется газ.
3. К раствору азотной кислоты приливают раствор гидроксида калия: выделяется теплота.
4. При смешивании растворов, например хлорида магния и сульфата натрия, никаких признаков химической реакции не наблюдается.
Существуют ли какие-нибудь закономерности в протекании таких реакций?
Чтобы получить ответ на этот вопрос, изобразим уравнения этих реакций не только в молекулярном виде, но и в виде ионных и сокращенных ионных уравнений, как это показано в таблице.
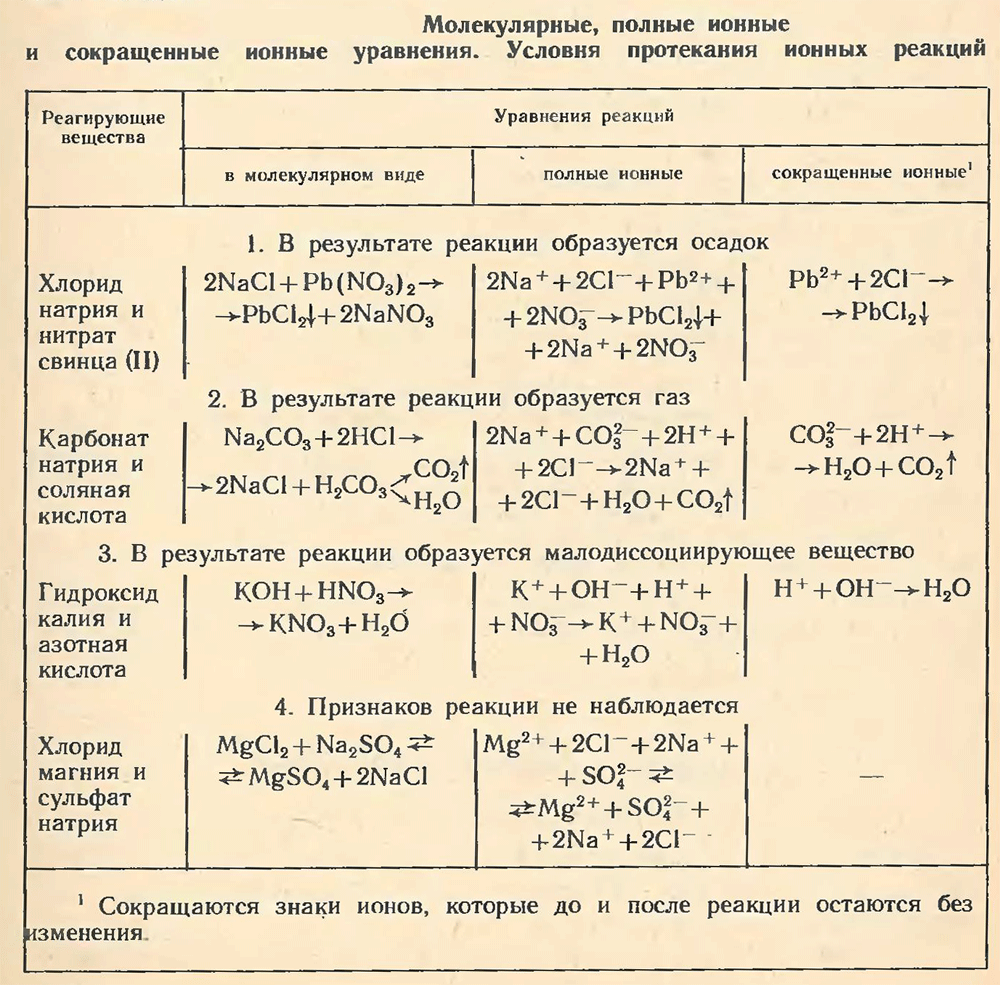
1) если образуется осадок;
2) если выделяется газ;
3) если образуется малодиссоциирующее вещество, например вода.
Если в растворе нет таких ионов, которые могут связываться между собой, реакция обмена является обратимой.
1. Убеждаются, растворимо ли взятое вещество, в данном случае MgCl₂, в воде.
2. Приходят к выводу, что MgCl₂ будет реагировать только с такими в воде растворенными веществами, которые способны осадить:
а) ионы Mg²⁺;
б) хлорид-ионы Cl⁻.
3. Ионы Mg²⁺ можно осадить:
а) ионами ОН⁻, т. е. нужно подействовать любой щелочью, что приведет к образованию малорастворимого Mg(OH)2;
б) при действии в воде растворимыми солями, содержащими один из следующих анионов — СО₃²⁻, РO₃⁴⁻, S²⁻, SiO₃²⁻. Для этого надо воспользоваться солями натрия, калия и аммония, содержащими указанные анионы, ибо только эти соли растворимы в воде.
4. Хлорид-ионы Сl⁻ можно осадить катионами Ag⁺ и РЬ²⁺. Поэтому для проведения реакции нужно воспользоваться растворимыми солями, содержащими эти катионы.
При составлении уравнения ионных реакций обмена, в которых образуются газообразные вещества, следует учесть, что анионы СО₃²⁻, SО₃²⁻ и S²⁻ способны реагировать с кислотами и выделять соответствующий газ,
SО₃²⁻ + 2Н⁺ → Н₂О + SO₂↑
В свете представлений об электролитической диссоциации кислот, оснований, амфотерных гидроксидов и солей общие свойства определяются общими ионами этих веществ.
